genetica
-

Mendelics Indica – filmes que abordam câncer de mama
No Outubro Rosa, a Mendelics preparou uma lista com filmes que retratam na ficção momentos vividos por pacientes com câncer de mama. Confira!
-

Mendelics Indica: A teoria de tudo
Saiba mais sobre o filme que retratou a vida de Stephen Hawking e a doença contra qual ele lutou durante toda sua vida: a esclerose lateral amiotrófica.
-

Mendelics: 10 anos de inovação no diagnóstico genético
Em 2022 a Mendelics completa 10 anos de inovações em busca do diagnóstico genético rápido, preciso e acessível para todos que precisam. Conheça a Mendelics!
-

Retrospectiva 2021 na área da genética
2021 foi marcado por muitos avanços na área de genética. Confira a nossa retrospectiva dos principais acontecimentos da área.
-

Sequenciamento Sanger: vantagens para a medicina contemporânea
Entenda sobre o sequenciamento Sanger, que possibilitou o sequenciamento do primeiro genoma humano e como ele é importante 20 anos depois.
-

Atletas Raros
Você sabia que vários de nossos atletas paralímpicos possuem doenças genéticas raras? Saiba mais sobre elas nesse artigo!
-

Forrest Gump: um retrato singular da Deficiência Intelectual
O Filme Forrest Gump, ganhador de 6 categorias do Óscar, aborda a Deficiência Intelectual de forma leve e cativante. Entenda mais.
-

Toda doença genética é herdada?
Doenças genéticas As doenças genéticas são causadas por uma ou mais alterações permanentes no DNA. Essas alterações podem ser passadas de geração em geração (mutações germinativas), com diferentes padrões de herança, ou surgir espontaneamente durante a vida (mutações somáticas). Existem centenas de milhares de doenças genéticas e cerca de 10.000 delas são monogênicas, isto é,…
-

Câncer hereditário: qual a relação da genética com o câncer?
São estimados 625 mil novos casos de câncer em 2021, sendo que até 10% desses casos são hereditários. Saiba mais sobre esse tipo de câncer.
-
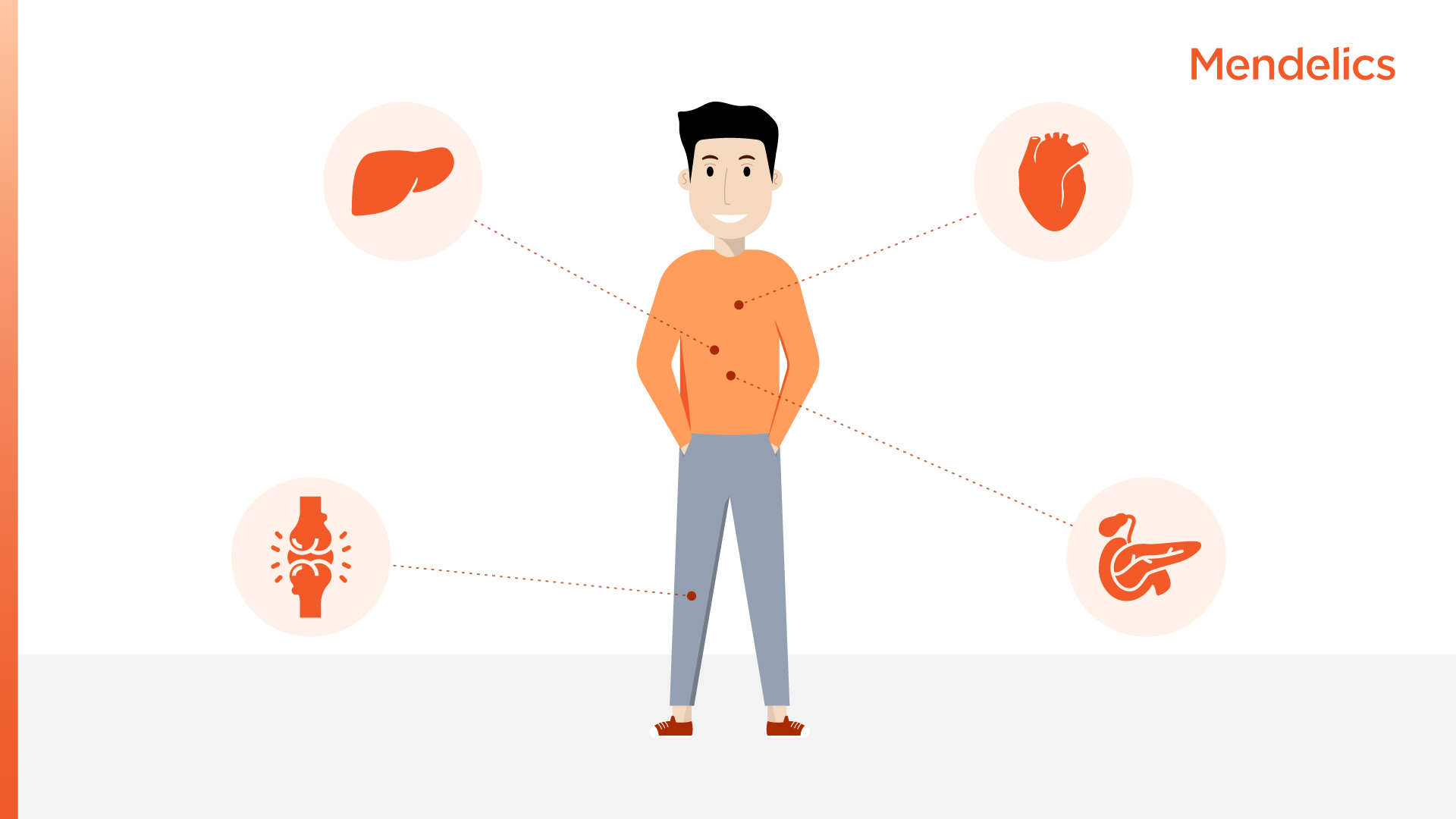
Você conhece a hemocromatose, a doença do Felipe Neto?
Felipe Neto publicou nas redes que foi diagnosticado com hemocromatose. Conheça mais sobre essa doença que afeta cerca de 1% da população.
-

Admirável Mundo Novo e a Manipulação Genética
Nesse post discutimos sobre o mundo distópico de Admirável Mundo Novo, o famoso romance de Aldous Huxley, e o que é pura ficção na narrativa.
